歡迎來到高新區數耕網絡科技工作室-專業無紡布袋定制、批發生產廠家! 381708881@qq.com 18482170382 |

細胞表面相關和細胞外基質 (ECM) 嵌入分子的時空組織模式在組織的發育和功能中起著重要作用。ECM 蛋白與生物支架聚合物的表面相互作用,并影響材料驅動的細胞分化控制。使用 X 射線相位對比微型計算機斷層掃描 (microCT),我們在體外接種誘導成肌分化、用氧化鐵納米粒子標記并接種到聚乙醇酸-聚乳酸支架上的骨髓衍生人類和鼠間充質干細胞 (MSC) 后,可視化了 ECM 組織的三維 (3D) 圖像。X 射線 microCT 使我們能夠以高空間分辨率檢測生物支架內 ECM 的 3D 結構組織以及細胞的存在如何改變構造排列。觀察到人類和鼠細胞產生的基質之間的物種特異性差異。總之,X 射線同步輻射 microCT 分析似乎是識別生物支架內 ECM 纖維組織時空模式的有用工具。
一、簡介
任何組織的工程都需要考慮材料和生物科學,并涉及支架材料和細胞之間的復雜相互作用。材料和細胞的最佳組合的選擇取決于在不同實驗條件下對這些組合項目性能的靈敏和定量測量。成像方式對工程組織的發育有巨大影響,需要設計創新的圖像處理方法。
微型計算機斷層掃描 (microCT) 是最先進的非侵入性技術之一,旨在定性和定量評估不同條件下的組織生長。它主要用于評估骨折愈合、骨骼發育和骨組織工程中的骨組織發育和再生。我們展示了使用 microCT 作為一種高空間分辨率(1.65 毫米)實驗技術來檢測用氧化鐵納米粒子標記的干細胞的可能性,這些干細胞在體外動脈內移植到營養不良小鼠的骨骼肌中。該技術還提供了獲得細胞分布的 3D 可視化的可能性。我們研究的數據表明,使用 microCT 可以可視化肌肉活檢中動脈內注射的 CD133+ 干細胞的分布,從而為肌肉干細胞歸巢的早期過程提供生物學見解。
不同類型的肌祖細胞已用于設計骨骼肌組織,包括肌肉來源的干細胞、骨髓來源的 MSCs、神經干細胞和循環 CD133+ 細胞。結合我們之前使用 X 射線微 CT 分析 MSC=生物支架結構用于組織工程以及在體內檢測肌祖細胞命運的經驗,我們測試了使用同步加速器分析揭示工程組織三個組成部分之間的結構相互作用的可行性:生物材料、細胞和細胞外基質 (ECM)。
生物支架為細胞附著和組織發育提供了模板。理想情況下,支架結構決定了營養物質和代謝物進出細胞的運輸。支架的空間結構和化學性質在細胞內信號傳導和基因表達中發揮著作用。
不同的材料已被用作肌肉組織工程的支架,特別是天然衍生材料,如膠原蛋白和藻酸鹽;細胞組織基質,如膀胱粘膜下層和小腸粘膜下層;和合成聚合物,特別是聚乙醇酸 (PGA),合成聚合物具有一些優點,例如使用非酶水解進行聚合物降解,并產生源自 PGA、PLLA 和 PLGA 的無毒分子,這些分子自然代謝并最終以二氧化碳和水的形式從體內排出。根據文獻數據以及我們對不同生物材料加載后細胞活力的初步測試結果,我們選擇 PGA/PLLA(50% 的 PGA 和 PLLA 混合物)作為合適的生物支架。
二、材料和方法
2.1 細胞
在獲得知情同意后,從健康供體(年齡范圍為 31-42 歲)的髂嵴骨髓抽吸物中獲得人類間充質干細胞 (hMSC)。如前所述,從 C57Bl=6 小鼠中獲得小鼠間充質干細胞 (mMSC)。簡而言之,殺死小鼠,用冷磷酸鹽緩沖鹽水 (PBS) 沖洗股骨和脛骨中的有核細胞,從而收集骨髓細胞。動物的護理和使用符合意大利衛生部的法律和歐洲共同體的指導方針。
在 Ficoll 分離液上純化有核細胞。將小鼠和人類細胞(10×10^6 有核細胞 = 10 厘米培養皿)培養在 Coon 改良的 F12 培養基中,該培養基中補充有 10% 胎牛血清 (FCS)、2 mM L-谷氨酰胺和 50 μg/mL 青霉素 = 鏈霉素(完全培養基)。在任何階段均未添加細胞因子。培養物在 37℃ 下在 5% 二氧化碳 (CO2) 的環境中孵育。3 天后,去除未粘附的細胞以消除造血來源的污染細胞。當細胞融合度達到 90% 時,將貼壁細胞用胰蛋白酶消化(0.05% 胰蛋白酶 = 乙二胺四乙酸,37℃,10 分鐘)并擴增(P1 階段)。
2.2 MSCs 成肌分化誘導和細胞標記
mMSCs 和 hMSC 被誘導體外分化為成肌譜系,如前所述。簡而言之,在第一代培養物(P1)收集 MSCs,將其重新接種到 6 孔板中,并在含有 1 ng=mL 堿性成纖維細胞生長因子 (bFGF) 的完全培養基中以 5×10^3 細胞/孔的密度培養。
當細胞達到融合度時,用 10 μM=L 5-氮雜胞苷 (5-Aza) (Sigma) 處理 24 小時(條件培養基)來誘導成肌分化。治療結束時,去除條件培養基,將細胞在完全培養基中培養 2 周,然后進行標記。為了測試 MSCs 在 PGA/PLLA 支架內的分布和成肌承諾,我們使用氧化鐵納米粒子標記 MSCs,這樣可以使用微型 CT 進行 3D 可視化。Endorem 是一種黑色至紅棕色的超順磁性氧化鐵水溶膠體,與葡聚糖結合,用于靜脈內給藥。用 250 μg/mL 氧化鐵納米粒子標記細胞,總鐵含量為 11.2 mg mL^(-1),由小的超順磁性氧化鐵顆粒組成。晶體尺寸從 4.3 到 5.6 nm 不等,平均粒徑為 150 nm。標記是將氧化鐵顆粒在標準細胞培養基中在 37℃、5% CO2 的環境下共培養 24 小時。
在標記實驗結束時,去除含有過量顆粒的培養基,并用無菌磷酸鹽緩沖鹽水 (PBS) 清洗間充質細胞三次,如前所述,將 Endorem 以 250 μg/mL 的濃度添加到培養基中。標記細胞在 37℃、5% CO2 的環境下培養 24 小時。
2.3 支架
支架由 PGA 和 PLLA 無紡布纖維的生物氈組成,每種纖維的百分比為 50%(現為 BIOFELT,Concordia Fibers,Coventry RI)。支架厚 0.5 毫米,密度為 50 mg/cc,平均直徑為 18 μm。支架是一種高度多孔的氈結構(孔隙率 > 97%),孔隙相互連通,孔徑通常在 50 至 200 μm 之間。

東莞市富臨塑膠原料有限公司 是 Confluent Medical 在中國的合作伙伴,富臨塑膠為中國客戶提供“服務”和供應“PGA Biofelt無紡布”。
將材料切成大約 1 cm2 面積和 500 mm 厚的薄片。
2.4 細胞接種
孵育并用 5-Aza 處理后,利用重力將 50×10^4 Endorem 標記的 MSCs 接種到 PGA/PLLA 支架上。
將細胞-支架構建體在 Coon’s F12 培養基中培養 15 天,培養基中添加的 FCS 數量逐漸減少,從 5% 血清濃度開始逐漸減少到 1% 血清(饑餓狀態),以促進 MSCs 的成肌承諾。
為了檢查接種的細胞是否經歷了成肌細胞分化,將一些樣品放入裂解緩沖液,并使用RNeasy Mini試劑盒(Qiagen)提取總RNA。用DNAse(無Rnase的DNA酶組,Qiagen)處理RNA以避免基因組DNA的污染。我們使用Superscript II第一鏈合成系統(Invitrogen)合成互補DNA(cDNA)。
我們使用標記物 MyoD 的引物進行逆轉錄聚合酶鏈反應,正向引物:5-ATCC GCTACATCGAAGGTCT-3,反向引物:5-CTCTGGTGTGCA TCTGCCA-3;肌生成素正向引物:5-CAGTACATTGAGCG CCTACA-3,反向引物:5-ACATATCCTCCACCGTGATG-3,結蛋白正向引物:5-ATCTCTGAGGCTGAAGAATGG-3,反向引物:5-GAGCAGAGAAGGTCTGGATAG-3。我們將基因表達水平與管家基因甘油醛-3-磷酸脫氫酶 (GAPDH) 的表達進行了比較。人類 GAPDH 正向引物:5-GAA GGTGAAGGTCGGAGTC-3,反向引物:5 -GAAGATG GTGATGGGATTTC-3。小鼠 GAPDH 正向引物:5 -CCATCTTCCAGGAGCGAGAC-3 ,反向引物:5 -GGC TAAGCAGTTGGTGGTGC-3 。
然后將其他樣品在磷酸鹽緩沖鹽水 (PBS) 中清洗 1X,在 3.7% 多聚甲醛中固定 30 分鐘,并在 70% 乙醇中保存以進行形態分析。
2.5 形態學研究
使用標準組織學技術將福爾馬林固定的標本進行石蠟包埋。固定兩個月后,切下 4 μm 的連續切片。用蘇木精和伊紅 (HE) 和過碘酸希夫 (PAS) 對切片進行染色以檢查形態。
對于透射電子顯微鏡 (TEM) 分析,將標本固定在 0.1 M 二甲胂酸鹽緩沖液 (pH 7.4) 中的 2% 戊二醛中,在 1% 四氧化鋨中后固定,在不斷增加的乙醇濃度中脫水,并嵌入 Araldite 中。使用 Eclipse E600 顯微鏡在 400X 下觀察用甲苯胺藍染色的半薄切片,使用 40X 物鏡,N.A. 0.75。使用尼康 Coolpix 數碼相機在 40X 下獲取切片圖像。使用飛利浦CM10 TEM 在 80 KV 下觀察用醋酸鈾酰和檸檬酸鉛復染的超薄切片。
2.6 X 射線相位對比微 CT 成像和圖像重建
使用微 CT 系統(Beamline BM05,歐洲同步輻射裝置 (ESRF) 格勒諾布爾)對每個樣品的 3D 結構形態進行非侵入式成像和量化。使用 20 KeV 能量的單色光束和 20 毫米的樣品到探測器距離進行微 CT 實驗。樣品保存在 70% 乙醇中,在數據采集前風干。
采集設置基于先前描述的 3D 平行斷層掃描。同步加速器成像序列期間樣品吸收的總輻射量限制為 0.2 Gy。掃描樣品,在 180° 范圍內為每個樣品獲得 1500 個投影。每個投影的曝光時間為 1 秒。使用與 FReLoN 2048×2048 CCD 相機(ATEG,ESRF 儀器支持組)相關聯的 Gadox 閃爍體作為探測器,像素大小設置為約 0.7 μm,可視場約為 1.5 mm。該系統獲得各向同性的切片數據,并將其重建為 2D 圖像。
使用在 ESRF 實施的 3D 濾波反投影算法,從一系列 2D 投影中獲得樣品的三維重建。此外,使用 3D 顯示軟件對不同的灰度相進行著色,使其更容易識別。為每個樣本重建了幾個約 (1000)3 體素的子體積,其中體素是空間三個方向上大小為 0.7 毫米的立方體。
2.7 3D 可視化
體積渲染是一種 3D 可視化方法,通過該方法直接渲染數據體積而不將其分解為幾何圖元。使用 2 GHz Pentium 和 1 Gb 隨機存取存儲器以及商業軟件 VGStudio MAX 1.1 生成 3D 圖像并以 3D 形式可視化相的分布。為了獲得最佳的圖像質量設置,我們使用了 Scatter HQ 算法,過采樣因子為 5.0,并激活了顏色渲染。
2.8 定量參數的提取
然后使用其他地方詳細描述的 3D 平均截距長度 (MIL) 方法的實現對不同相進行量化。通過計算自動分離不同相的算法標記的體素數量來計算不同的體積。使用和中提出的算法測量感興趣的支架傳輸特性,例如曲折指數、平均楊氏曲率、彎曲能量、圓度、凸度、偏心率和堅固性。
2.9 統計分析
結果表示為平均值±平均值的標準誤差。使用 Sigma Stat 4.0 軟件進行非配對學生 t 檢驗,統計顯著性定義為 p < 0.05。
三、結果
3.1 支架結構的 3D 表征
在 MSC 接種之前對不同的 PGA/PLLA 樣品進行成像。當使用光學顯微鏡、掃描電子顯微鏡、microCT 分析支架的子體積時,樣品之間的內部微結構沒有顯著差異(圖 1),表明圖像彼此相關。使用 microCT 確認 PGA/PLLA 支架 (BIOFELT) 由纖維組成(圖 1C)。然后使用空間計算分析技術量化 PGA/PLLA 纖維圖像的 3D microCT。表 1 報告了從 3D microCT 掃描中提取的支架的結構和功能特征,例如纖維表面與纖維體積之比 (FS=FV)、纖維體積與總體積之比 (FV=TV)、平均直徑纖維和纖維相平均長度。纖維直徑的平均值±標準偏差為 15.5±4.7 μm。平均總孔隙率約為 95%。這些支架的測量定量參數與制造商報告的參數一致。由于傳輸特性會影響組織形成,我們還考慮了相關參數。根據 microCT 測量的支架傳輸特性如表 2 所示。所有支架樣品的曲折指數似乎都有利于組織生長,考慮到 1.41 至 1.78 范圍內的曲折度最適合通過全局互連的多孔空間進行質量傳輸。

圖 1. 純纖維聚乙醇酸-聚乳酸支架。間充質干細胞接種前支架子體積的光學 (A) 和掃描電子顯微鏡 (B) 顯微照片以及三維微型計算機斷層掃描圖像 (C)。

表 1. 接種前支架的結構參數。

表 2. 接種前支架的運輸特性。
3.2 細胞接種后對 PGA/PLLA 支架的修改
3D microCT 分析能夠輕松區分空的 PGA/PLLA 結構和細胞負載的 PGA/PLLA 支架(圖 2)。細胞-支架相互作用導致 PGA/PLLA 結構發生改變,產生的圖像中明顯存在兩個具有不同衰減系數的不同相(圖 2)。使用 3D 顯示軟件對不同相進行著色,使其更容易識別。未改性的 PGA/PLLA 纖維顯示為綠色,由在生物支架上生長的細胞產生的纖維基質薄層顯示為紅色。這些層部分連接到纖維并覆蓋了纖維本身網絡中的某些區域(圖 2B、C)。對于接種了 mMSC 和 hMSC 的支架,測量的層平均厚度分別為 5.4±1.3 μm 和 2.7±0.7 μm,兩者均用鐵納米粒子標記(圖 2B、C)。支架的正面部分強化了 3D 成像提供的信息(圖 3A-C)。很容易看出,盡管在無細胞培養的支架中沒有紅色層狀相的證據(圖 3A),但在用 hMSC(圖 3B)和 mMSC(圖 3C)培養的支架中都可以看到該相。為了使這種證據更清晰,繪制了“體素數量與實驗衰減系數”的曲線(圖 3D)。
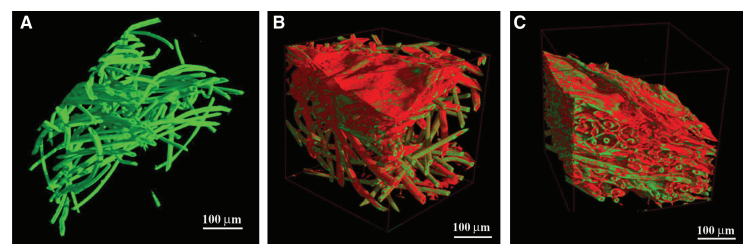
圖 2. 接種間充質干細胞 (MSC) 之前和之后的纖維聚乙醇酸-聚乳酸支架。無細胞培養 (A) 和有人類 MSC (B) 和小鼠 MSC (C) 培養 15 天的支架子體積的三維 (3D) 顯示,其中使用 3D 顯示軟件對不同階段進行著色,以便更容易識別:纖維支架 (綠色)、薄細胞外基質 (紅色)。
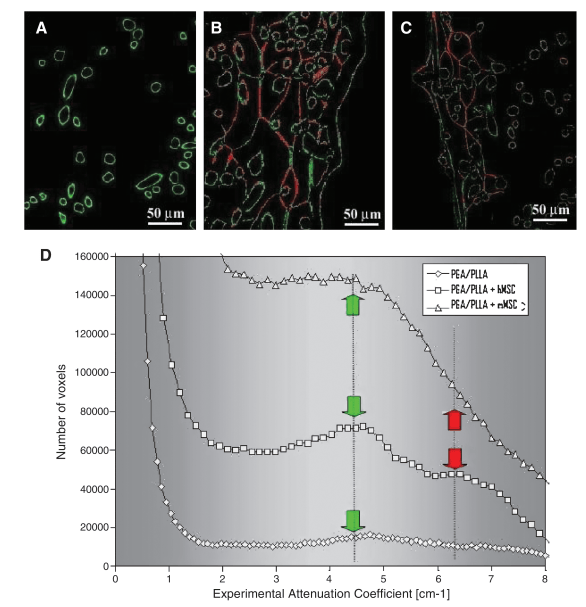
圖 3. 新細胞外基質形成的證據。二維 (2D)(微型計算機斷層掃描正面部分)顯示培養 15 天的無細胞支架 (A)、有人類間充質干細胞 (hMSCs) (B) 和鼠間充質干細胞 (mMSCs) (C) 的支架亞體積,其中使用 3D 顯示軟件對不同階段進行著色,以便更容易識別:纖維支架 (綠色)、薄層基質 (紅色)。無細胞 (?) 和有 hMSCs (□) 和 mMSCs (△) 的支架 (D) 的實驗衰減系數直方圖。綠色箭頭表示聚乙醇酸-聚乳酸纖維;紅色箭頭表示新形成的纖維狀基質。
為了從分析的樣本中獲得定量數據,對裝有 hMSC 和 mMSC 的支架中新形成的層狀結構進行了比較(圖 4)。通過計算其相應的體素來計算纏繞在支架纖維(綠色)之間的新結構(圖 3 中的紅色)的數量,使用一種自動將其與其他相分離的算法。獲得的數據以體素數(圖 4A)和體積分數(細胞衍生結構體積=總體積=CV/TV)(圖 4B)表示,這些體積分數在分析的樣本體積(1.5 mm×1.5 mm×1.5 mm)中。
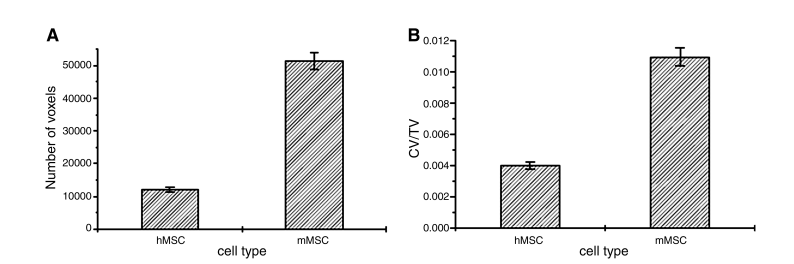
圖 4. 支架內基質纖維的定量評估。(A) 對應于由人類間充質干細胞 (hMSC) 和鼠間充質干細胞 (mMSC) 沉積的基質纖維的體素數量。(B) hMSC 和 mMSC 沉積的基質纖維的體積分數 (細胞體積 = 總體積)。在這兩種情況下,平均值和標準偏差均對應于在樣本的小區域中獲得的值,每個值均歸一化為總分析樣本體積 (1.5 mm×1.5 mm×1.5 mm)。
物種特異性定量差異決定了 hMSC 和 mMSC 產生的組織量;相同數量的加載 mMSC 產生的沉積基質數量明顯更多。
3D 圖像(圖 5)的詳細說明揭示了薄層纖維基質的存在,可能對應于纖維組織的特定時空模式。最初,一些細絲沉積在支架纖維上,形成稀疏結構(階段 I);然后它們似乎以鏈狀組織(階段 II),最后細絲鏈層似乎以更厚的結構形式組織(階段 III)。在裝有 hMSC 和 mMSC 的樣本中,纖維組織及其與支架的連接相似。

圖 5. 使用 X 射線微型計算機斷層掃描檢測細胞外基質。支架纖維和沉積基質的三維顯示 (A)。“階段”被放大。基質原纖維最初沉積在支架纖維上 (階段 I) (B)。在階段 II,它們似乎在不同位置以鏈狀排列 (C)。在第三階段,鏈似乎在不同位置組織成網絡,表明聚集過程有助于形成基質層 (D)。
3.3 PGA/PLLA 支架內新組織結構的表征
由于細胞被誘導成成肌細胞分化,我們首次嘗試集中于檢查新結構是否與肌肉形成的初始步驟相對應。培養 15 天后,從細胞-生物支架結構中提取總 RNA(數據未顯示),標記物 MyoD、肌生成素和結蛋白的表達分析表明,hMSC 和 mMSC 的成肌分化特異性 cDNA 不存在(數據未顯示),支持以下觀點:加載的細胞仍留在支架內,沒有經歷成肌細胞分化(數據未顯示)。
形態學分析顯示 HE 和 PAS 染色切片中存在 MSC。新形成的組織被描述為透明基質,具有 PAS 陽性纖維狀結構,在切片的某些部分看起來更致密(數據未顯示),表明存在高比例的碳水化合物大分子,例如糖原、糖蛋白和蛋白聚糖,這些物質通常存在于結締組織的 ECM 中。
光學顯微鏡分析確定該組織是由連接到支架結構的 ECM 纖維組成的結締組織(圖 6a)。一些含有鐵顆粒的細胞遍布整個基質(圖 6c)。沒有發現有組織的骨骼肌組織(肌管或肌纖維)的證據。
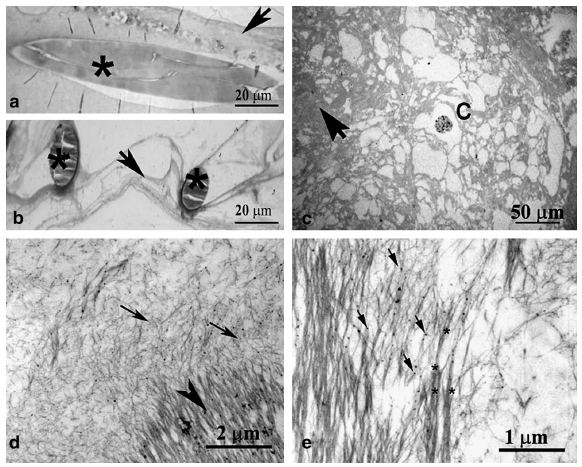
圖 6. 聚乙醇酸-聚乳酸 (PGA/PLLA) 支架內細胞外基質 (ECM) 纖維的組織。使用光學 (a-c) 和電子 (d、e) 顯微鏡進行形態學研究。半薄切片表明存在膠原樣纖維 (箭頭),與縱向切片的 PGA/PLLA (*) 結構交織在一起 (a)。橫截面中的 PGA/`PLLA (*) 被 ECM 材料包圍 (b)。鐵標記細胞 (C) 和纖維 ECM (箭頭) 明顯 (c)。透射電子顯微鏡 (TEM) 圖像顯示,由較厚的定向纖維結構 (箭頭) 和隨機定向的組織不良的細纖維 (箭頭) 組成的兩種不同成分 ECM (d)。在匯合區域觀察到纖維組裝方面的進展 (*)。電子致密體(箭頭)可能與鐵納米粒子有關,可在 ECM 原纖維(e)上檢測到。(a、b、c)在光學顯微鏡下觀察到的甲苯胺藍染色的半薄切片。(d、e)TEM 下的薄切片。
與同步加速器圖像相呼應,薄切片的 TEM 分析(圖 6d、e)表明,兩種不同的成分由高度定向的長纖維結構和長度較短且隨機定向的組織不良的纖維組成,分別在致密和疏松區域中具有相似的超微結構方面,反映了不同程度的基質組織,主要由 ECM 制成的膠原樣纖維。在界面區,在更高的放大倍數下觀察到纖維在致密有序基質中的組裝進展(圖 6e)。在 ECM 纖維中也可以檢測到可能與鐵納米顆粒有關的電子致密體。
四、討論
組織工程的目的是開發合適的生物材料和細胞組合來替代有缺陷的組織。當前的研究重點是控制生物支架結構內的細胞分化,祖細胞可以在其中找到有利于組織發育的微環境。一個重要的潛在混雜因素涉及細胞對這些材料及其微環境的分泌反應。細胞不斷分泌復雜的 ECM 蛋白混合物和其他細胞行為調節劑,這可能會影響植入外源性細胞或材料時發生的情況。
我們的研究表明,PGA/PLLA 使 MSCs 傾向于分泌 ECM 蛋白,盡管用 5-Aza(一種用于誘導成肌分化的因子)處理,但仍可能延遲或阻礙其分化為骨骼肌細胞。缺乏成肌環境和機械力可能導致負載的 MSCs 無法分化為肌肉細胞。此外,PGA/PLLA 支架的 3D 結構可能會影響 MSCs 的行為,因為它們分散在支架內而沒有細胞間接觸。mMSC 分泌的 ECM 蛋白量高于 hMSC,證實了 MSC 的物種特異性行為。
盡管由于 X 射線吸收率低,不建議單獨使用 microCT 來分析樣本中的軟組織,但我們能夠使用下面描述的特殊裝置檢測支架纖維之間的 ECM 組織。與實驗室或工業 X 射線源相比,使用同步加速器 X 射線有幾個優勢,包括高光子通量,允許以高空間分辨率進行測量;可調 X 射線源,允許以不同的能量進行測量;使用單色 X 射線輻射,消除了光束硬化效應;平行光束采集,允許使用精確的斷層重建算法。此外,我們使用半相襯裝置進行了實驗,這增強了可視化不同相之間界面的可能性,在我們的實驗中突出了 ECM 的組織。從同步加速器分析推斷出的圖像表明 ECM 纖維根據時空模式聚集。在支架的其他部分,孤立的膠原樣纖維似乎聚集在逐漸變厚的層中,表明接種細胞不斷分泌基質,覆蓋了一些支架區域。鐵標記細胞或鐵納米顆粒的存在似乎沒有干擾X射線微CT對ECM結構的檢測。在這種情況下,非侵入性和定量的X射線微CT可以被認為是挑戰組織工程研究中新應用的潛在重要工具。當前的顯微鏡技術(例如本研究中也用于比較分析的TEM)僅限于2D局部信息,否則需要費力的3D連續切片重建。在這里,我們確定了使用同步加速器分析來描繪與PGA / PLLA生物支架接觸的MSCs分層基質纖維網的精細時空組織的可行性。
責任編輯: